Холерные вибрионы убивают сородичей, чтобы присвоить их гены
9 января 2015
Некоторые бактерии используют для убийства других микробов «секреторную систему типа VI» (T6SS) — молекулярный комплекс, составленный из белков вирусного происхождения, при помощи которого бактерии-убийцы протыкают оболочку соседних клеток и вводят в них токсичные вещества. Как выяснилось, у холерных вибрионов убийство соседей при помощи T6SS напрямую связано с заимствованием генетической информации у погибших клеток. Гены вибриона, необходимые для «естественной трансформации» (поглощения чужой ДНК и встраивания ее в свой геном), включаются в ответ на те же сигналы, что и гены, отвечающие за формирование T6SS, а убийство соседних клеток резко повышает вероятность встраивания генов жертв в геном клетки-убийцы.
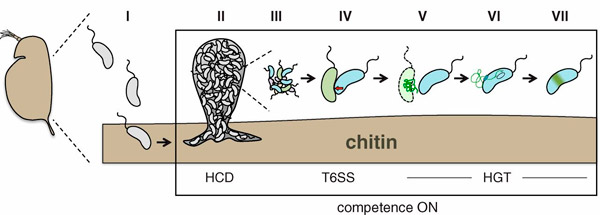
Рис. 1. Убийство конкурентов и присвоение их генов холерными вибрионами. В своей естественной среде обитания холерные вибрионы часто поселяются на хитиновых шкурках планктонных животных, сброшенных при линьке (I). На хитиновой поверхности микробы образуют плотные скопления (II; HCD — high cell density, высокая плотность клеток), где присутствуют вибрионы разных штаммов с различающимися парами токсин–антитоксин (III). Высокая плотность популяции в присутствии хитина индуцирует переход вибрионов в состояние «компетентности» — способности к захвату чужой ДНК. Те же факторы включают и генетическую программу формирования секреторной системы шестого типа, T6SS (IV, красная стрелка) — молекулярного «шприца», служащего для протыкания клеточной стенки других бактерий и введения токсина. Жертвы, не имеющие соответствующего антитоксина, погибают; их клетки разрушаются (V). Из клеток высвобождается ДНК, поглощаемая хищником (VI). Заимствованные гены могут затем встроиться в хромосому хищника (HGT — horizontal gene transfer, горизонтальный перенос генов), что приводит к появлению у него новых фенотипических признаков (VII). Рисунок из обсуждаемой статьи в Science
Горизонтальный перенос генов (ГПГ) играет огромную роль в эволюции одноклеточных организмов. Одним из основных способов ГПГ у прокариот является естественная трансформация — активное поглощение ДНК из внешней среды с последующим встраиванием фрагментов чужого генетического материала в свой геном. Как правило, микробы не занимаются трансформацией постоянно. Чтобы приступить к трансформации, микроб должен перейти в так называемое «состояние компетентности»: у него должны включиться гены, необходимые для поглощения ДНК из окружающей среды, ее транспортировки через клеточные оболочки и т. д. Эти гены обычно включаются в ответ на определенные стимулы, так или иначе связанные со стрессом или неблагоприятными условиями. Это логично, поскольку в условиях, к которым организм приспособлен плохо, случайное изменение генома с большей вероятностью может оказаться полезным.
Чаще всего встраивание чужих генов происходит путем замены фрагмента собственной ДНК на похожий заимствованный фрагмент (см. Homologous recombination). В результате один аллель данного гена может быть заменен на другой. При этом чем выше сходство двух последовательностей, тем выше вероятность рекомбинации. Это одна из причин, объясняющих, почему ГПГ у прокариот чаще происходит между близкородственными видами и штаммами. Заимствование генов у неродственных организмов может иметь важные макроэволюционные последствия, но это куда более рискованное предприятие, чем близкородственный ГПГ, который у прокариот служит аналогом полового процесса и играет заметную роль в микроэволюции (см.: В эволюции бактерий горизонтальный генетический обмен играет ту же роль, что и половое размножение у высших организмов, «Элементы», 09.04.2012).
По-видимому, некоторые бактерии могут специально убивать сородичей, чтобы поживиться их генами. Это явление, получившее название фратрицида (братоубийства), обнаружено у бактерий Streptococcus pneumoniae. «Компетентные» стрептококки выделяют токсины, убивающие соседние клетки, не успевшие перейти в состояние компетентности, а затем поглощают их ДНК. Правда, чужая ДНК может использоваться бактериями не только как источник нового генетического материала, но и просто в качестве пищи (эпизодическая рекомбинация в этом случае может быть побочным эффектом заглатывания чужой ДНК). Тогда следует говорить не об «убийстве с сексуальными целями», а об обычном каннибализме, как у Bacillus subtilis (см.: Бактерии-альтруисты помогают своим сородичам-каннибалам себя съесть, «Элементы», 27.02.2006). Но вряд ли это так в случае со стрептококками, ведь они переходят в состояние компетентности и начинают выделять «братоубийственные» токсины не при голодании, а как раз наоборот — при быстром росте популяции в условиях пищевого изобилия (Jean-Pierre Claverys & Leiv S. Håvarstein, 2007.Cannibalism and fratricide: mechanisms and raisons d'être).
В статье швейцарских биологов, опубликованной в свежем выпуске журнала Science, описан еще один пример убийства бактериями своих сородичей с последующим присвоением наследственного материала жертв. Объектом исследования на этот раз стал холерный вибрион Vibrio cholerae. Его способ убийства себе подобных оказался более изощренным, чем у стрептококков. Как выяснилось, холерные вибрионы убивают соседние клетки при помощи секреторной системы типа VI (T6SS). Это сложный молекулярный комплекс, по своей конструкции и аминокислотным последовательностям составляющих его белков очень похожий на сократимую ножку-«шприц» бактериофага T4. При помощи этой белковой конструкции бактериофаг протыкает оболочку бактериальной клетки и впрыскивает в нее свою ДНК (рис. 2). Бактерии, у которых есть T6SS, используют ее в аналогичных целях — для протыкания оболочек других бактериальных или эукариотических клеток и введения в них тех или иных веществ — «эффекторов» (M. Basler, M. Pilhofer, G. P. Henderson, G. J. Jensen & J. J. Mekalanos, 2012. Type VI secretion requires a dynamic contractile phage tail-like structure). Многим бактериям T6SS служит оружием как для охоты с целью добычи пропитания, так и для устранения конкурентов.
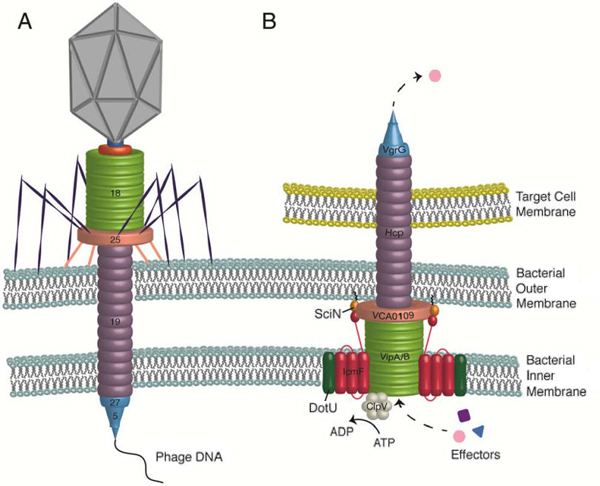
Рис. 2. Бактериофаг (слева, A) и секреторная система типа VI (справа, B). Гомологичные белки раскрашены одинаково. Изображение из статьи Angela R. Records, 2011. The Type VI Secretion System: A Multipurpose Delivery System with a Phage-Like Machinery
Ранее было показано, что разные штаммы холерных вибрионов активно «воюют» друг с другом при помощи T6SS. Впрочем, до настоящего братоубийства, как у стрептококков, дело не доходит. Каждый штамм вибрионов обладает иммунитетом (белковым противоядием) к токсичному «эффектору», производимому им самим. Поэтому вибрионы каждого штамма убивают только чужаков с отличающимися парами «яд–противоядие», а для ближайшей родни их токсины безвредны.
Авторы обсуждаемой статьи изучали систему регуляции генов компетентности у одного из опаснейших штаммов холерного вибриона El Tor, который вызвал пандемию холеры в 1960-х. Они выяснили, что несколько генов, необходимых для поглощения чужой ДНК, включаются в ответ на комбинацию двух стимулов. Первый стимул — хитин, в присутствии которого вибрионы начинают производить регуляторный белок TfoX (transformation protein X). Дело в том, что холерные вибрионы обитают в водоемах, где они размножаются на поверхности тел мелких планктонных членистоногих или на их хитиновых шкурках, сброшенных при линьке. На поверхности хитина холерные вибрионы образуют плотные скопления — биоплёнки.
Белок TfoX, сигналом к производству которого служит присутствие хитина или продуктов его разложения, необходим, но не достаточен для перехода вибрионов в состояние компетентности. Вторым сигналом является высокая плотность популяции вибрионов, которую микробы оценивают по концентрации выделяемых ими веществ (аутоиндукторов) при помощи системыquorum sensing («чувства кворума»).
Авторы решили выяснить, какие еще гены входят в «регулон компетентности», то есть включаются под действием белка TfoX при высокой плотности популяции и исправной системе quorum sensing. Для этого они сравнили транскриптомы вибрионов, выращенных при высокой плотности, с включенным и выключенным геном tfoX (так называется ген, кодирующий белок TfoX).
Оказалось, что вместе с генами, необходимыми для поглощения чужой ДНК, у вибрионов включаются также и гены белков секреторной системы типа VI. Система регуляции у тех и других оказалась общей: в обоих случаях ключевую роль играет TfoX (синтез которого индуцируется хитином) и белки, участвующие в quorum sensing. Отключение любого из этих компонентов лишает вибрионы одновременно и способности переходить в состояние компетентности, и возможности производить молекулярные «шприцы» T6SS.
Единая регуляция молекулярных устройств, служащих для убийства других бактерий и для захвата чужой ДНК, указывает на возможное единство их функций. Иными словами, можно предположить, что вибрионы сначала убивают соседей, относящихся к другим штаммам, а затем поглощают их ДНК. Для проверки этой гипотезы авторы провели ряд экспериментов. Для начала они убедились, что включение генов T6SS (в присутствии хитина или в результате искусственной стимуляции у вибрионов, у которых ген tfoX был соединен с промотором, индуцируемым арабинозой) действительно способствует гибели других бактерий, контактирующих с вибрионами-«хищниками». Сначала в качестве «жертв» использовали кишечных палочек Escherichia coli, которых растили в смешанной культуре с вибрионами. В последующих экспериментах в роли жертв выступали холерные вибрионы другого штамма, у которых их собственная T6SS была отключена (чтобы жертвы не могли убивать хищников). Всё подтвердилось: жертвы погибали, когда у хищников включался ген tfoX, но оставались живы, если либо tfoX, либо система quorum sensing у хищников не работала.
Теперь нужно было проверить, действительно ли вибрионы присваивают гены убитых бактерий. Для этого в геномы хищников и жертв добавили гены устойчивости к двум антибиотикам — рифампицину и канамицину. Оказалось, что при включенном tfoXсреди хищников систематически появляются особи, устойчивые к обоим антибиотикам одновременно. Это доказывает, что ГПГ от жертв к хищникам действительно имеет место. При выключенном tfoX или неисправной системе quorum sensing клетки с двойной устойчивостью почти никогда не появляются. Этот значит, что хищные вибрионы действительно поглощают ДНК убитых ими жертв и встраивают заимствованные гены в свой геном, причем убийство соседей резко повышает частоту ГПГ.
Авторам удалось получить наглядную визуализацию процесса «охоты», гибели клеток-жертв и поглощения хищниками чужой ДНК. Для этого они изготовили генно-модифицированных хищников и жертв. Клетки-жертвы были помечены зеленым флуоресцирующим белком (GFP), а у клеток-хищников зеленым был помечен белок VipA (один из компонентов T6SS), а красным — белок ComEA (один из белков системы компетентности, который плавает в периплазматическом пространстве и связывается с попадающей туда чужой ДНК). В результате удалось получить серии фотографий, подробно рассказывающие о судьбе вибрионов-хищников и их жертв в смешанной культуре (рис. 3). Фотографии не оставляют сомнений в том, что хищники действительно убивают других вибрионов при помощи T6SS, а затем поглощают их ДНК.
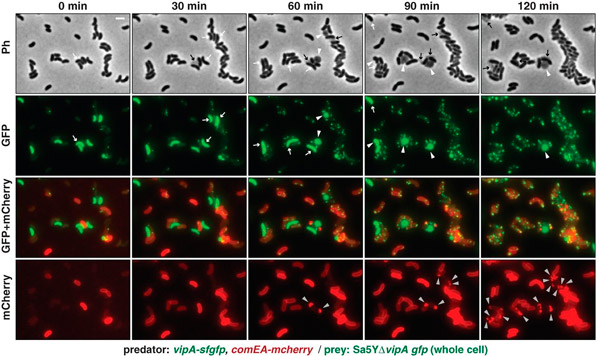
Рис. 3. Вибрионы-«хищники» убивают вибрионов-«жертв» при помощи T6SS и поглощают их ДНК. В каждом ряду — фотографии одного и того же участка субстрата с нанесенной на него смесью хищников и жертв, сделанные с интервалом в 30 минут. Верхний ряд снимков сделан при помощи фазово-контрастной микроскопии. Во втором ряду видны помеченные зеленым флуоресцирующим белком клетки вибрионов-жертв; мелкие зеленые точки и палочки — системы T6SS вибрионов-хищников на разных стадиях сборки и деградации этих систем. Белыми стрелками обозначены клетки жертв до того, как на них напали хищники, белыми треугольничками — те же клетки после нападения (перед тем, как разрушиться, клетки приобретают округлую форму). Черными стрелками отмечены останки разрушенных клеток. В нижнем ряду виден помеченный красным белок ComEA, компонент системы компетентности, который сначала был равномерно распределен в периплазматическом пространстве хищников. При попадании в периплазматическое пространство молекул ДНК этот белок связывается с ними и собирается в компактные комки (помечены серыми треугольничками). По появлению таких комков можно судить о поглощении хищниками чужой ДНК. В третьем ряду — комбинация изображений из второго и четвертого рядов. Рисунок из обсуждаемой статьи в Science
Пока нет оснований утверждать, что сопряженная регуляция T6SS и компетентности у холерных вибрионов возникла именно как адаптация для приобретения чужого генетического материала, а не просто для эффективной утилизации устраняемых конкурентов (с чисто гастрономическими целями), причем присвоение чужих генов в этом случае следует рассматривать как побочный эффект. Поэтому слово «чтобы» в названии новости не нужно воспринимать слишком буквально. Так или иначе, после убийства жертв часть их генетического материала действительно переносится в геном убийц, что может иметь важные эволюционные и медицинские последствия. Ведь холерные вибрионы благодаря ГПГ могут быстро приспосабливаться к меняющимся условиям, в том числе и к новым антибиотикам, передавая гены устойчивости от одного штамма к другому. Кроме того, способность убивать других бактерий, возможно, помогает вибрионам расправляться с конкурентами в пищеварительном тракте человека, уничтожая нашу симбиотическую микрофлору, что может способствовать более тяжелому протеканию инфекции.
По материалам сайта www.elementy.ru


